INTRODUCCION:
Los elementos químicos se combinan de diferentes maneras para formar toda una variedad de compuestos inorgánicos y orgánicos. Hay compuestos gaseosos, líquidos y sólidos, los hay tóxicos e inocuos, mientras que otros son altamente benéficos para la salud. Las propiedades de cada compuesto dependen del tipo de elemento químico que lo forman, el modo cómo se enlazan (tipo de enlace químico), la forma y geometría de los agregados atómicos (moléculas) y de como estos interactúan entre si.
En 1916, el químico alemán Walther Kossel expuso que en las reacciones químicas ocurren perdida y ganancia de electrones por parte de los átomos, y por ello estos adquieren la configuración electrónica de un gas noble. Sin duda Kossel se refería al enlace iónico, y por lo tanto a los compuestos iónicos.
Posteriormente los químicos norteamericanos Gilbert Newton Lewis e Irving Langmuir, cada uno en forma independiente estudiaron los compuestos iónicos y no iónicos (covalentes), comprobando que los átomos al formar enlace químico adquieren en su mayoría la estructura atómica de un gas noble (8 electrones en el nivel externo), lo que hoy se llama Regla del Octeto.
En 1923, G.N.Lewis plantea su teoría de enlace por pares de electrones y anuncia que el octeto se logra por medio de compartición de electrones. Entonces a Kossel lo podemos considerar como el padre del enlace iónico, y a Lewis el padre del enlace covalente.
En 1926, Walter Heitler y Fritz London demostraron que el enlace covalente en la molécula de H2 se podría explicar mediante la mecánica cuántica.
La mecánica cuántica describe muy bien a los átomos y estructura electrónica de los mismos; pero la situación en la molécula es muy diferente debido a la mayor complejidad de esta, el aparato matemático es mucho mas difícil de formular y los resultados menos fáciles de obtener e interpretar.
Hoy en día, los químicos disponen de métodos de calculo y de técnicas experimentales muy sofisticadas que permiten conocer con exactitud la forma, geometría y dimensiones de las moléculas.
CONCEPTO:
El enlace químico es la fuerza que mantiene unidos a los átomos (enlace interatómico) para formar moléculas o formar sistemas cristalinos (iónicos, metálicos o covalentes) y moléculas (enlace intermolecular) para formar los estados condensados de la materia (sólido y líquido), dicha fuerza es de naturaleza electromagnética (eléctrica y magnética), predominante fuerza eléctrica.
PRINCIPIO FUNDAMENTAL:
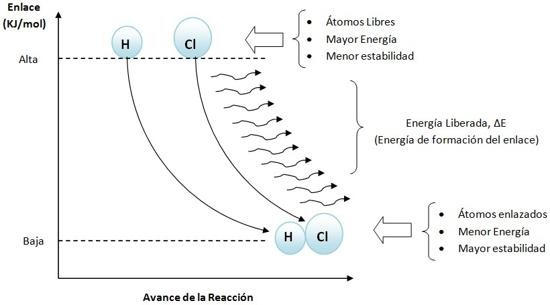
Los átomos y moléculas forman enlaces químicos con la finalidad de adquirir un estado de menor energía, para asa lograr una condición de mayor estabilidad. En el caso de los átomos, la estabilidad se reflejara en un cambio de su configuración electrónica externa.
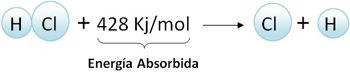
Veamos la formación de la molécula de HCl

La misma energía se requiere como mínimo para romper o disociar el enlace (energía de disociación)
Con una gráfica veamos la variación de energía en la formación del enlace.
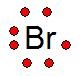
NOTACION O FORMULA DE LEWIS:
Es la representación convencional de los electrones de valencia (electrones que intervienen en los enlaces químicos), mediante el uso de puntos o aspas que se colocan alrededor del símbolo del elemento.
En general para los elementos representativos (recordar que el numero de grupo indica el numero de electrones de valencia) tenemos:

[Ejercicios sobre estructura de Lewis – Entrar ]
REGLA DEL OCTETO:G.N.Lewis, al estudiar la molécula de hidrógeno (H2) notó que cada átomo al compartir electrones adquiere dos electrones, o sea la estructura electrónica del gas noble Helio (2He) y comprobó también que los demás átomos que comparten electrones al formar enlace químico, llegan a adquirir la estructura electrónica de los gases nobles.
Existen muchas e importantes excepciones a la regla del octeto, por lo tanto no hay que sobrevalorar la importancia ni aplicabilidad de esta regla. Dichas excepciones las trataremos posteriormente.
[Ejercicios sobre la regla del octeto – Entrar]
CLASIFICACION DE ENLACES QUIMICOS:1. Enlaces Interatómicos:
2. Enlaces Intermoleculares o Fuerzas de Van der Waals:
- Enlace dipolo – dipolo
- Enlace puente de hidrógeno
- Enlace por fuerzas de London
- [Video] Teoría sobre el enlace quimico – Entrar
- [Video] Ejemplo de enlace químico – Entrar
- Video sobre enlace ionico, covalente y metalico – Entrar
Link sobre enlace : http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/enlaces1.htm





